
催奇形性が極めて強いことで知られるアビガン、コロナ治療薬として開発が進められており、一時期もてはやされましたが、現在は承認が保留となっています(継続審査中)
承認の保留は主に有効性面の問題ですが、アビガンには催奇形性という大きな問題がありました。
催奇形性の何がそんなに問題なのか?という方もおられるかもしれません。
そこで今日は催奇形性で社会問題になったサリドマイドの薬害の歴史や現在の承認薬としての概要、催奇形性を決して出さないようにするための対策について、インタビューフォームや審査報告書、安全性管理手順書をもとに簡単にまとめてみたいと思います。
サリドマイドの薬害を契機として、行政でも規制が強化されたのですが、それはまた別の機会に取り上げさせていただきます。
今日はサリドマイドや催奇形性のことをあまり知らない方に知っていただきたいという観点で、なるべくわかりやすい言葉で書いたつもりですが、分かりにくいところがありましたら申し訳ありません。
サリドマイドの薬害の歴史
サリドマイドは1950年代に当時の西ドイツで鎮静・催眠薬(睡眠薬)として開発されました。
世界各国(※アメリカは除く:後述)でも販売され、もちろん日本でも販売されていました。
発売当初は「毒性が全くない」などとうたわれ、使いやすい※OTC睡眠薬として妊婦さんのつわり等にも使用されていましたが、末梢神経炎の副作用により、医療用医薬品となりました。
※OTC:Over the counter、カウンター越しに買える薬、つまり薬局やドラッグストアで買える薬のこと
ここまでは大したことない話だったのですが、ここからがまずいのです。
1960年頃、ドイツにて手や足がアザラシのように短い状態で生まれる奇形児の報告が相次ぎ、騒ぎとなりました。
これがサリドマイドの服薬が原因であることに気づいたレンツ医師が警告し、サリドマイドは回収となったのです。
世界においては数千~1万人もの奇形児や産まれる前に亡くなってしまうケースが見られました。
これが有名なサリドマイドの催奇形性の薬害です。
日本における対応の失敗
さて日本ではどうだったのでしょうか。
先に申し上げておきますと、日本における対応は最低最悪でした。
被害を最小限に抑えるどころか、無駄に広げてしまい、歴史に残る大失態を演じてしまったのです。
日本においてはとある製薬会社が独自に製造を行い、日本での臨床試験を実施しない状態で申請が行われました。
そして日本での有効性や安全性の「審査はあっという間(わずか2時間弱)に終わり」1958年に販売開始されました。
これは「海外で使用されている医薬品の審査は簡易でよいという慣習」に基づくものでした。
すぐに承認されたサリドマイドは睡眠薬や胃薬として販売され、医療用のみならず、OTC(薬局やドラッグストアで買える薬)としても使用されたのです。
その際の売り文句は「クセにならなくて安心」や「妊婦にも安全」です。
ひどすぎますね。
1961年に世界中でサリドマイドの回収が始まっても、当時の厚生省は「科学的根拠がない」と受け付けず、1962年まで販売を継続してしまいました。
むしろこの間、別の会社のサリドマイドの申請を承認しています。
この回収の遅れにより被害は拡大し、おおもとのドイツに次ぐ世界2位の被害者数を記録することとなってしまいました。
(約1,000人の胎児の被害と言われています。)
回収自体も不徹底で被害を拡大した要因の一つともいわれています。
この人災とも言える薬害を契機として、日本では様々な制度が整備され、規制当局としても、二度と催奇形性の薬害を出さないことを誓ったのでした。
なおアメリカはFDAのケルシー長官が「安全性データの不足や内容に疑問」を持ち、承認が遅れており、市販されていなかったため、被害はほぼありませんでした。(試作品を飲んだ方に少数の被害あり)
英雄ですね。
アメリカは雑だとか言えないですよね。
彼女達はデータに基づき、厳正に審査した結果、薬害から国民を守ることに成功したのです。
サリドマイドの復活の歴史
睡眠薬としてのサリドマイドは完全に終わりましたが、思わぬところで復活を遂げます。
その後の研究により、サリドマイドに炎症性サイトカインのTNF-αの産生抑制や血管新生抑制等の作用を持つことが分かったのです。
要は「炎症を抑えたり、抗腫瘍効果がある」ということです。
この作用機序を元にドラッグリポジショニングされ、サリドマイドは「多発性骨髄腫」や「らい性結節性紅斑」の治療薬として世界10ヵ国以上で承認されることとなりました
日本においては、2005年2月に多発性骨髄腫(既治療で効果不十分な場合に限る)に対する希少疾病用医薬品の指定を受け、治療抵抗性の多発性骨髄腫を対象とした国内臨床試験(第Ⅱ相試験)を実施され、その後承認されました。
またらい性結節性紅斑については、日本ハンセン病学会から効能追加の要望書が提出され2010年5月に厚生労働省から開発要請がなされました。
こちらについては国内患者数が少ないことから、国内臨床試験を実施せず国内外の治療ガイドライン、教科書、公表文献及び国内の使用実態報告に基づき追加承認されました。
あれだけの被害を出したサリドマイドも「使いようによっては有用な薬に生まれ変われる」ということですね。
ただし、当然野放しでは使うことができません。
また人類史上に残る薬害を繰り返すわけにはいかないからです。
ではどんな対策の元、使用が許可されているのでしょうか?
見ていきましょう。
おまけ:名前の由来
日本におけるサリドマイドの製品名は「サレドカプセル」です。
この名前の由来に安全性に対する誓いが込められているのはご存じですか?
サレドという名前は、成分名であるサリドマイド(THAL IDOMIDE)と、安全管理のための教育(ED UCATION)の意味を込めてサレド(THALED)としているのです。
日本における規制と対策
さてまずは添付文書の警告について、催奇形性に関連する部分をまとめてみましょう
・本剤はヒトにおいて催奇形性(サリドマイド胎芽病:無肢症、海豹肢症、奇肢症等の四肢奇形、心臓疾患、消化器系の閉塞等の内臓障害等)が確認されいる
妊婦又は妊娠している可能性のある婦人には「決して」投与しないこと
・本剤の胎児への曝露を避けるため、本剤の使用については、安全管理手順が定められているので、関係企業、医師、薬剤師等の医療関係者、患者やその家族等の「全ての関係者」が本手順を遵守すること
・妊娠する可能性のある婦人に投与する際は、投与開始前に妊娠検査を行い、陰性であることを確認したうえで投与を開始すること。
女性も男性も投与開始予定4週間前から投与終了4週間後まで避妊必須(精液中へ移行する)
・本剤の投与は、緊急時に十分対応できる医療施設において、十分な知識・経験を持つ医師のもとで、本剤の投与が適切と判断される患者のみに行うこと。
また、治療開始に先立ち、患者又はその家族等に有効性及び危険性(胎児への曝露の危険性を含む)を十分に説明し、文書で同意を得てから投与を開始すること。
男性も女性も服薬中は当然として、前後約1か月ずつ避妊が必要になります。
そして投与に際しては文書同意が必要になります。
これだけだと、まぁそうなんだくらいな気もしますが、文中に記載のある安全管理手順というものがかなり厳格な手順となっています。
安全管理手順
参考リンク:サリドマイド製剤安全管理手順
さて実際の遵守すべき安全管理手順には何が書かれているのか見ていきたいのですが、この資料、申請書等含めて69ページもあるのです。
とてもではないですが、ここで分かりやすく説明できません。
それだけ厳密に定められた手順だということです。
ざっと大きな流れを申し上げますと
「教育⇒登録⇒流通や処方の管理⇒薬剤管理⇒妊娠検査」のような流れで組まれています。
これだけでは厳格さが分かりにくいかもしれないので、例を挙げてみましょう。
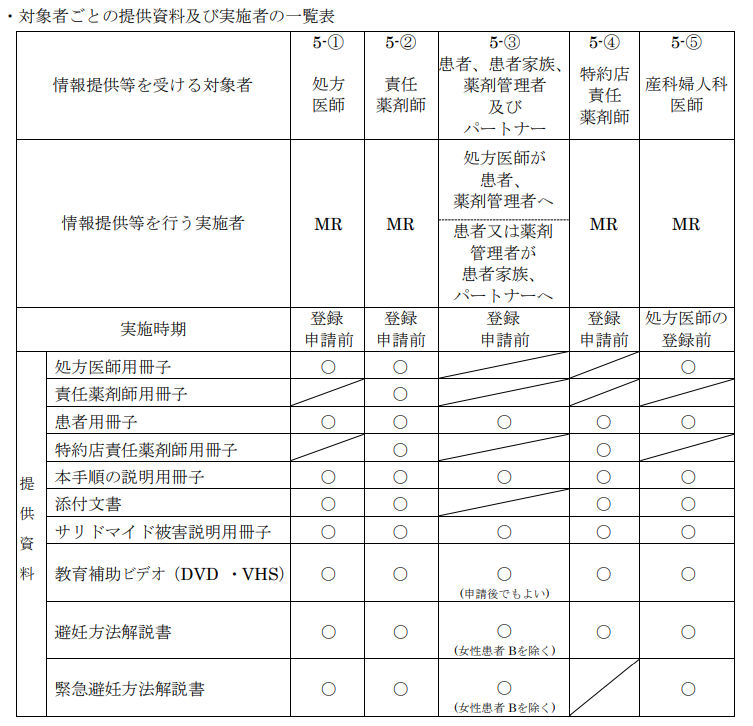
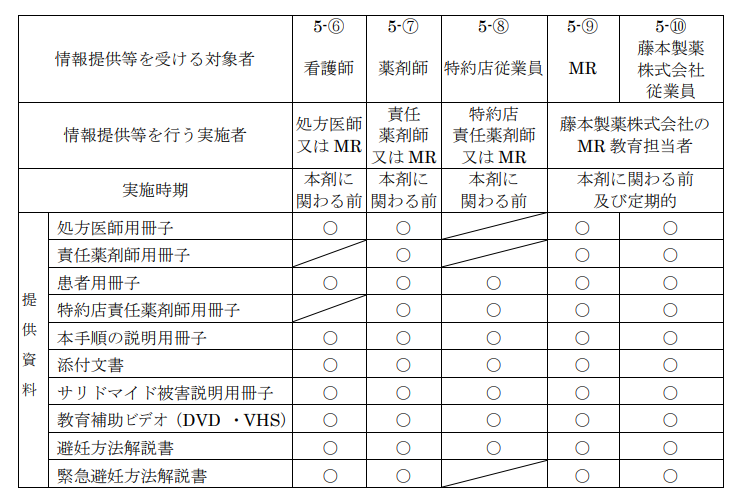
こちらは「教育」の過程を示した図です。
まずはこれらの関係者が全て教育を受けなければならないのです。
これは必須です。
普通のお薬ではこんなことありませんよね?
登録についても見てみましょう
登録申請は処方医師、責任薬剤師、特約店責任薬剤師が必要です。
申請者は、登録要件を満たした上で、同意書(別添様式 1~3、8)及び登録申請書(別
286 添様式 10、11、13)を用いて FAX、郵送又は MR による搬送により製薬会社に申請が必要となります。
また患者さんの登録申請は、処方医師が実施する必要があります。
処方医師は、登録要件を満たした患者についてのみ、登録申請書(別添様式 12)を用いて FAX、郵送又は MR による搬送により製薬会社に申請します。
ご興味のある方は安全管理手順書の各書式を見て頂ければと思いますが、非常に大変ですね。
お薬を処方するだけでここまでするかという厳格な手順が敷かれているのです。
アビガンを気軽に使ってもよいのか?
※この項目はアビガンが承認されなさそうなので削除しました。杞憂ってことで!
みなさんもサリドマイドの薬害の歴史を振り返り、今一度医薬品の承認審査や催奇形性の副作用について、思いを巡らせていただけますと嬉しいです。
参考
・アビガンの催奇形性について、インフルエンザの審査報告書から考察
【COVID-19】アビガンの審査報告書を読んで、催奇形性の副作用について考えよう!【コロナ】
・特例承認制度についての解説
特例承認ってなに?なぜアビガンではなくレムデシビルなの?その妥当性は?
・医薬品の一般的な承認審査の流れ
医薬品の承認申請から販売開始までの流れとは?一般的な流れを解説
※当ブログにおける見解は個人的見解であり、所属する企業の見解ではございません。また特定の銘柄の購入を推奨するものではありません。







